AFINIDAD ELECTRONICA
La afinidad electrónica de un elemento (AE), puede definirse como:
La cantidad de energía que se absorbe cuando se añade un electrón a un átomo gaseoso aislado para formar un ión de carga 1-
La convención es asignar un valor positivo cuando se absorbe energía y un valor negativo cuando se libera y caso todos los elementos no tienen afinidad por un electrón adicional, por tanto, su afinidad electrónica es igual a cero. La afinidad electrónica de los elementos He y Cloro puede representarse como:
He(g) + e- x He- (g) AE = 0 kj/mol
Cl(g) + e- → Cl- (g) + 349 kj AE = -349 kj/mol
La primera ecuación nos dice que el Helio no admitirá un electrón. La segunda ecuación nos dice que cuando una mol de átomo de cloro gaseoso gana un electrón para formar iones cloruro gaseoso, se libera (exotérmico) 349 kj de energía.
La afinidad electrónica comprende la adición de un electrón a un átomo gaseoso neutro. Así como el proceso por el cual un átomo neutro X gana un electrón.
X(g) + e- →X-(g) (AE)
no es el inverso del proceso de ionización
X+(g) + e- →X(g) ( inverso de EI1)
El primer proceso comienza con un átomo neutro en tanto que el segundo comienza con un ión positivo; por tanto, los valores de EI1 y de la AE no son simplemente iguales pero de signo contrario. En la figura 6.3 vemos que, al recorrer un periódo de la tabla periódica la afinidad electrónica se vuelve, en general,más negativa de izquierda a derecha ( excluyendo a los gases nobles), lo cual significa que casi todos los elementos representativos de los grupos 1A a 7ª muestran gran atracción por un electrón extra de izquierda a derecha. La afinidad electrónica más negativa corresponde a los átomos de los halógenos, cuya configuración electrónica más externa es ns2np5, los cuales forman aniones estables con configuración de gas noble, ns2np6 al ganar un electrón.
Los elementos con afinidad electrónica muy negativa gana electrones con facilidad formando iones negativos (aniones).
La afinidad electrónica es un término preciso y cuantitativo como la energía de ionización, pero es difícil medirla.



 .
.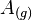 los átomos en estado gaseoso de un determinado elemento químico;
los átomos en estado gaseoso de un determinado elemento químico;  , la energía de ionización y
, la energía de ionización y 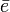 un electrón.
un electrón. von Hevesy
von Hevesy Coster
Coster































 H.Davy
H.Davy Gay-Lussac
Gay-Lussac L.J Thenard
L.J Thenard
